|
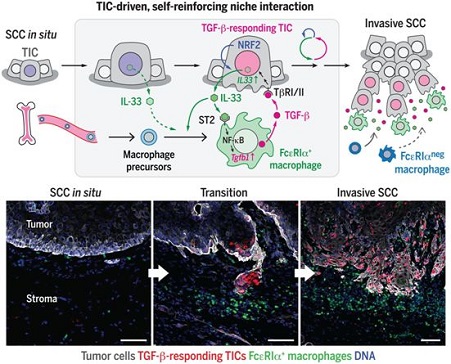
研究发现TIC和FcεRIα+巨噬细胞之间存在IL-33-TGF-β壁龛信号循环小部分具有长期致瘤能力的肿瘤细胞,即肿瘤起始细胞(tumor-initiating cell, TIC),在癌症的发展和治疗抵抗性中起着关键作用。然而,由于缺乏对TIC脆弱性的识别,有效的TIC靶向疗法的开发进展受限。 正如正常干细胞受到来自特定微环境(即干细胞壁龛)的外部线索调控一样,TIC的干细胞样状态及其后代的恶性表型(malignant phenotype)受到来自TIC相关肿瘤微环境(即所谓的TIC壁龛)的各种因素控制。因此,从机制上理解TIC和TIC壁龛(TIC niche)之间的相互作用,可以加速持久性癌症治疗药物的开发。 虽然TIC壁龛被认为是通过与TIC的双向互动而演化的,但是在肿瘤发展过程中,TIC-TIC壁龛相互作用的机制却不甚明了。已知实体瘤在基质中招募免疫细胞,为它们的生长和生存创造有利条件。然而,人们对于TIC如何调控TIC支持性免疫细胞在它们的空间附近的定位和功能还知之甚少。 在一项新的研究中,通过着重关注TGF-β反应性TIC附近的细胞因子环境(cytokine milieu)和免疫细胞,这些研究人员确定了TIC如何产生一种空间上独特的壁龛微环境,这是SCC的浸润性进展和耐药性所必需的。
在寻找邻近肿瘤微环境的潜在旁分泌调节剂时,发现白细胞介素-33(IL-33)是TGF-β反应性TIC中上调最高的细胞因子。鉴于IL-33在正常情况下储存在细胞核中,发现它在NRF2介导的抗氧化反应中被释放到细胞外空间,这是TGF-β反应性TIC的标志。这种源自TIC的IL-33是SCC的浸润性进展和耐药性所必需的。 从机制上讲,IL-33诱导一部分表达IL-33受体ST2和高亲和力IgE受体(FcεRIα)的肿瘤相关巨噬细胞亚群在接近TIC的地方(即半径50μm内)堆积。这些以前未被重视的FcεRIα+巨噬细胞从骨髓源细胞中分化并交替激活,通过IL-33-ST2-NF-κB通路构建出一种富含TGF-β的壁龛微环境,从而诱导TGF-β信号旁分泌到TIC,并进一步上调IL-33的表达。阻断该通路或清除FcεRIα+巨噬细胞,都可减少TGF-β反应性TIC数量,降低浸润性肿瘤进展速度和化疗耐药性。 治疗抵抗性的TIC被认为是癌症治疗失败的主要元凶。通过研究小鼠模型,这些研究人员揭示了TIC壁龛形成的细胞和分子基础,其中TIC壁龛促进SCC恶性进展和出现耐药性。 研究人员发现TIC和FcεRIα+巨噬细胞之间存在IL-33-TGF-β壁龛信号循环,这为自我强化TIC-TIC壁龛相互作用提供了机制上的新见解。这种相互作用可能是破坏TIC稳定以提高癌症治疗效果的潜在靶标。 |