|
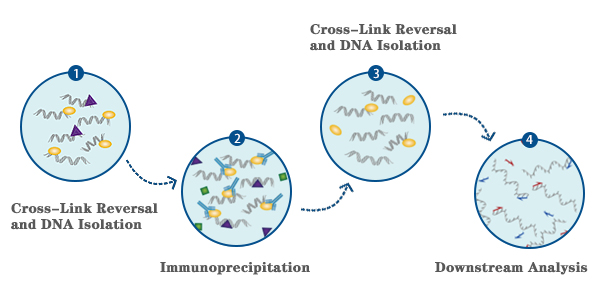
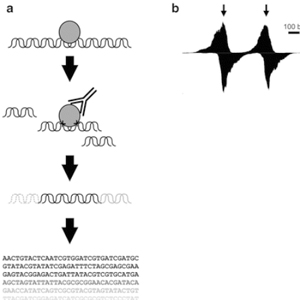
染色质免疫沉淀染色质免疫沉淀 (Chromatin-immunoprecipitation , ChIP)是一种在细胞天然染色质背景下探测蛋白质-DNA相互作用的技术,用于检测与基因组某个特定区域有关的多种蛋白,或用于检测某种特殊蛋白结合的基因组的多个区域。除了组蛋白外,ChIP 测定法还可用于分析转录因子与辅助因子、DNA 复制因子和 DNA 修复蛋白的结合。进行 ChIP 检测时,先用甲醛固定细胞或组织,“维持”细胞中的蛋白-DNA 相互作用。染色质采集后使用超声处理或酶消化法进行碎裂,随后用对某种特殊蛋白或组蛋白修饰具有特异性的抗体进行免疫沉淀。任何与目标蛋白或组蛋白修饰有关的 DNA 序列都会作为交联染色质复合体的一部分进行共沉淀,并且该 DNA 序列的相对数量会在免疫选择过程中得到富集。免疫沉淀后,解除蛋白质-DNA 的联,纯化DNA。最后用实时定量PCR 测量DNA 序列的数量,还可与高通量测序、基因组微芯片(芯片上的 ChIP)技术或克隆策略联合使用,它们都能对蛋白-DNA 相互作用和组蛋白修饰进行全基因组分析。
实验步骤 一. 甲醛交联和染色质样品制备 为达到最佳染色质免疫沉淀法结果,每次免疫沉淀使用大约 4 x 106 细胞进行实验(至少需要 12 x 106 个细胞以包含阴性对照和阳性对照)。对于 Hela 细胞,一次免疫沉淀相当于 15 cm 培养皿所含细胞(在 20 mL 生长培养基中的融合度为 90%)的一半。 1 取出1平皿细胞,加入37%甲醛,使得甲醛的终浓度为1%,37℃孵育10 min。 2 终止交联:加2.5 M甘氨酸至终浓度为0.125 M,在室温下放置5 min。 3 移除培养基,用冰的PBS清洗细胞2次。 4 用细胞刮刀收集细胞于15 mL离心管中(PBS依次为5 mL,3 mL和3 mL)。4℃ 2000 rpm离心5 min后收集细胞。 5 倒去上清。根据照细胞量,加入SDS Lysis Buffer。使得细胞终浓度为每100 μL溶液含1x106个细胞,再加入蛋白酶抑制剂 。 6 超声破碎: 30%功率,10sec超声,10 sec间隙,共30次。 7 取100μL超声破碎后产物,加入2μL 5M NaCl和2μL蛋白酶K,65℃孵育2 h,进行解交联。 8 用离心柱纯化DNA,琼脂糖电泳检测超声破碎效果。 二、染色质免疫沉淀及清洗 1 将超声破碎的产物离心去除沉淀后,在100μL上清中,加入900μL ChIP 稀释液和20μL的蛋白酶抑制剂,取20μL为Input ,其余的分成3份(实验组、阴性对照、阳性对照)。 2 抗体孵育。实验组中加入目的蛋白抗体,阴性对照组中加入IgG抗体,阳性对照组中加入组蛋白H3抗体,4℃旋转过夜。 3 磁珠孵育。每管中加入60μL Protein G磁珠,4°C 振荡孵育2h。 4 将试管放在磁力架上至溶液澄清,使DNA-抗体-磁珠复合物完全沉淀后,移除上清液。 5 加入1mL低盐洗液来洗涤Protein G 磁珠沉淀复合物,然后在4°C旋转孵育 5 min,移除上清液。再重复步骤两次,以确保总共进行 3 次低盐洗涤。 6 加入1mL 高盐洗液并且在 4℃ 下旋转孵育5min,移除上清液。 三、染色质洗脱和解交联 1 加入300 μL ChIP 洗脱缓冲液, 65°C涡旋,将NDA从抗体-Protein G 磁珠上洗脱下来,持续 30min。10000g离心分离 10 sec,以去除微量离心管盖上的蒸发样品。 2 将试管放在磁力架上让 Protein G磁珠沉淀,并等待 1-2min让溶液变澄清,小心地将洗脱下来的染色质上清液转移至新试管。 3 向试管中加入 6μL 5M NaCl和2μL蛋白酶K,65°C孵育2h,进行解交联。 四、纯化 DNA 1 添加 750μL DNA Binding Buffer到每份 DNA 样品中,涡旋片刻,转移450μL到收集管中的 DNA 离心柱上14000 rpm离心 30 sec。 2 取出离心柱并丢弃液体,再放入收集管中,加入 750 μLDNA Wash Buffer 到收集管中的离心柱上,14000 rpm离心 30 sec。 3 取出离心柱并丢弃液体,再放入收集管中,14000 rpm离心30 sec,丢弃收集管和液体,保留离心柱。 4 加入50μL DNA Elution Buffer,并放在 1.5 mL干净的微量离心管中。 5 14000 rpm离心 30 sec,以洗脱 DNA,取出并丢弃 DNA 离心柱,洗脱物即纯化的 DNA。 五、定量PCR分析或高通量测序(ChIP-seq)
参考文献 [1]. Valerio Orlando,Mapping chromosomal proteins in vivo by formaldehyde-crosslinked-chromatin immunoprecipitation, Trends in Biochemical Science, 2000, 25(3),99-104. [2]. Theodora Agalioti, Stavros Lomvardas, Bhavin Parekh, Junming Yie, Tom Maniatis, Dimitris Thanos,Ordered Recruitment of Chromatin Modifying and General Transcription Factors to the IFN-β Promoter,Cell, 2000,103(4), 667-678. [3]. Julie Wells, Peggy J. Farnham,Characterizing transcription factor binding sites using formaldehyde crosslinking and immunoprecipitation,Methods,2002, 26(1), 48-56. [4]. Lee TI, Jenner RG, Boyer LA, et al. Control of developmental regulators by Polycomb in human embryonic stem cells. Cell. 2006;125(2):301–313. [5]. Wang J, He N, Zhang N, et al. NCoR1 restrains thymic negative selection by repressing Bim expression to spare thymocytes undergoing positive selection. Nat Commun. 2017;8(1):959. [6]. Wade J.T. (2015) Mapping Transcription Regulatory Networks with ChIP-seq and RNA-seq. In: Krogan, PhD N., Babu, PhD M. (eds) Prokaryotic Systems Biology. Advances in Experimental Medicine and Biology, vol 883.
客户提供材料 1 需检测的细胞/目的基因/目的蛋白信息(种属)。 2 可提供ChIP级别的抗体以及相应的检测试剂盒。
结果交付 1 完整的实验报告(包含实验原理、使用仪器、试剂来源、实验步骤、实验结果)。 2 附件: ChIP-qPCR的检测结果或者ChIP-seq的测序结果及分析。
上一篇单细胞测序下一篇EMSA(凝胶迁移实验) |